?導(dǎo)管鞘組預(yù)期用于將導(dǎo)絲���、導(dǎo)管等醫(yī)療器械插入血管�����。通常 由導(dǎo)管鞘����、擴(kuò)張器組成����,包括進(jìn)入心腔的導(dǎo)管鞘。導(dǎo)管鞘組在我國(guó)屬于第二類醫(yī)療器械注冊(cè)產(chǎn)品�����,�����。含有潤(rùn)滑涂層的導(dǎo)管鞘組產(chǎn)品除參照本要點(diǎn)中相關(guān)要求���,還 應(yīng)參照《帶有潤(rùn)滑涂層的血管介入器械注冊(cè)審查指導(dǎo)原則》中相 關(guān)要求執(zhí)行�。
導(dǎo)管鞘組預(yù)期用于將導(dǎo)絲��、導(dǎo)管等醫(yī)療器械插入血管�。通常
由導(dǎo)管鞘、擴(kuò)張器組成���,包括進(jìn)入心腔的導(dǎo)管鞘����。導(dǎo)管鞘組在我國(guó)屬于第二類醫(yī)療器械注冊(cè)產(chǎn)品��,�。含有潤(rùn)滑涂層的導(dǎo)管鞘組產(chǎn)品除參照本要點(diǎn)中相關(guān)要求,還
應(yīng)參照《帶有潤(rùn)滑涂層的血管介入器械注冊(cè)審查指導(dǎo)原則》中相
關(guān)要求執(zhí)行���。
一�、導(dǎo)管鞘組產(chǎn)品技術(shù)要求示例
醫(yī)療器械產(chǎn)品技術(shù)要求編號(hào):
導(dǎo)管鞘組
1.產(chǎn)品型號(hào)/規(guī)格及其劃分說(shuō)明
1.1 結(jié)構(gòu)組成
導(dǎo)管鞘組由擴(kuò)張器和導(dǎo)管鞘組成�����,其結(jié)構(gòu)示意圖見圖 1
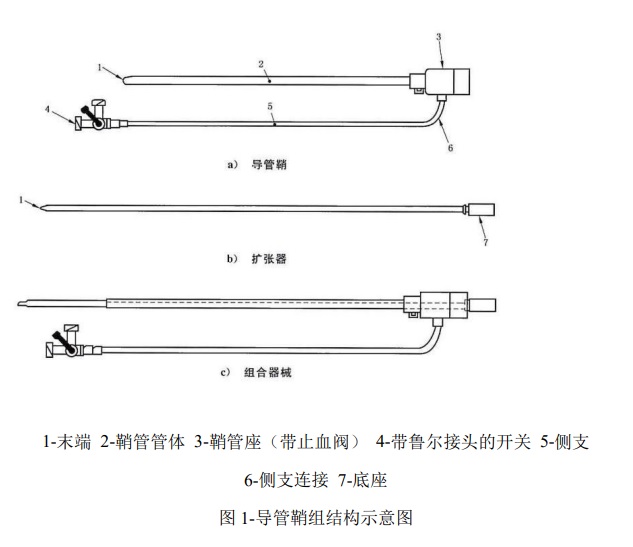
1.2 型號(hào)規(guī)格
導(dǎo)管鞘組根據(jù)導(dǎo)管鞘內(nèi)徑的不同分為六種型號(hào)/規(guī)格:5F、6F���、
7F����、8F�����、9F 和 10F����。
1.3 材料
導(dǎo)管鞘組的組件材料見表
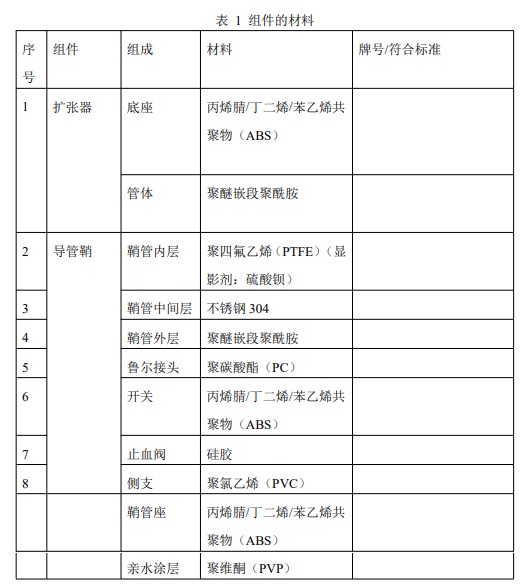
2.性能指標(biāo)
2.1 物理性能
2.1.1 擴(kuò)張器的物理性能
2.1.1.1 外觀
擴(kuò)張器有效長(zhǎng)度的外表面應(yīng)無(wú)雜質(zhì); 擴(kuò)張器有效長(zhǎng)度的外表面����,包括末端,應(yīng)無(wú)加工缺陷和表面缺陷���,如涂有潤(rùn)滑劑����,有效長(zhǎng)度外表面不應(yīng)看到匯聚的潤(rùn)滑劑液滴。
2.1.1.2 尺寸
擴(kuò)張器的尺寸應(yīng)符合表 2 的規(guī)定�����。
表 2 擴(kuò)張器尺寸(略)
2.1.1.3 座
如果座上有一個(gè) 6%(魯爾)錐度內(nèi)圓錐接頭,應(yīng)符合 GB/T 1962.1 和/或 GB/T 1962.2 的
規(guī)定�����。
2.1.1.4 座與擴(kuò)張器的連接強(qiáng)度
按照 YY0450.1-2020 附錄 C 試驗(yàn)時(shí)��,擴(kuò)張器及擴(kuò)張器與座連接處的峰值拉
力應(yīng)符合 YY0450.1-2020 中表 2 的要求���。
2.1.1.5 耐腐蝕性(如適用)
按照 YY0450.1-2020 附錄 B 試驗(yàn)時(shí),擴(kuò)張器應(yīng)無(wú)腐蝕痕跡���。
2.1.2 導(dǎo)管鞘的物理性能
2.1.2.1 外觀
導(dǎo)管鞘有效長(zhǎng)度的外表面應(yīng)無(wú)雜質(zhì)�;導(dǎo)管鞘有效長(zhǎng)度的外表面���,包括末端�,應(yīng)無(wú)加工缺陷和表面缺陷���,且有效長(zhǎng)度外表面不應(yīng)看到匯聚的潤(rùn)滑劑液滴����;
導(dǎo)管鞘的止血閥、側(cè)支以及帶魯爾接頭的開關(guān)應(yīng)清潔無(wú)雜質(zhì)���,應(yīng)無(wú)加工缺陷和表面缺陷����。
2.1.2.2 尺寸
導(dǎo)管鞘的尺寸應(yīng)符合表 3 的規(guī)定����。
表 3 導(dǎo)管鞘尺(略)
2.1.2.3 無(wú)泄漏
按照 YY0450.1-2020 附錄 D 試驗(yàn)時(shí),在最小 300kPa 壓力下�����,泄漏不應(yīng)足以形成液滴��。
2.1.2.4 止血閥無(wú)泄漏 (如適用)
按照 YY0450.1-2020 附錄 E 試驗(yàn)時(shí)��,止血閥不應(yīng)產(chǎn)生泄漏����。
2.1.2.5 座
導(dǎo)管鞘側(cè)支開關(guān)上的魯爾接頭應(yīng)為符合 GB/T 1962.2-2001 的 6%(魯爾)錐度的鎖定式內(nèi)圓錐接頭。
2.1.2.6 峰值拉力
按照 YY0450.1-2020 附錄 C 試驗(yàn)時(shí)��,導(dǎo)管鞘管、導(dǎo)管鞘與座連接處�����、座與
側(cè)支�����、側(cè)支�����、側(cè)支與開關(guān)連接處的最小峰值拉力應(yīng)符合 YY0450.1-2020 中表 2 的規(guī)定�。
2.1.2.7 射線可探測(cè)性 (如適用)
導(dǎo)管鞘的鞘管應(yīng)能被 X 射線探測(cè)到�����。
2.1.2.8 耐腐蝕性(如適用)
按照 YY0450.1-2020 附錄 B 試驗(yàn)時(shí)��,導(dǎo)管鞘應(yīng)無(wú)腐蝕痕跡�。
2.1.3 微粒
導(dǎo)管鞘組的微粒污染指數(shù)應(yīng)不超過 90。
2.2 化學(xué)性能
2.2.1 酸堿度
導(dǎo)管鞘組檢驗(yàn)液與空白液作對(duì)照��,pH 值之差不得超過 1.5����。
2.2.2 還原物質(zhì) (如不適用����,應(yīng)明確不適用的理由���,并提供相關(guān)研究資料)
20mL 檢 驗(yàn) 液 與 空 白 液 作 對(duì) 照 相 比 ��, 高 錳 酸 鉀 溶 液 [c(KMn04) =0.002mol/L]消耗量之差應(yīng)不超過 2.0mL�����。
2.2.3 重金屬總含量
導(dǎo)管鞘組檢驗(yàn)液中重金屬含量應(yīng)不超過 1.0μg/mL����,鎘含量應(yīng)不超過
0.1μg/mL���。
2.2.4 蒸發(fā)殘?jiān)?nbsp;
50mL 檢驗(yàn)液中���,蒸發(fā)殘?jiān)目偭繎?yīng)不超過 2.0mg。
2.2.5 紫外吸光度
檢驗(yàn)液在 250nm-320nm 波長(zhǎng)范圍內(nèi)的吸光度應(yīng)不超過 0.1�。
2.3 環(huán)氧乙烷殘留量
導(dǎo)管鞘組的環(huán)氧乙烷殘留量應(yīng)不大于 10μg/g。
2.4 無(wú)菌
導(dǎo)管鞘組應(yīng)無(wú)菌���。
2.5 細(xì)菌內(nèi)毒素
導(dǎo)管鞘組細(xì)菌內(nèi)毒素限量每件不超過 20EU����。
3.檢驗(yàn)方法
3.1 物理性能
3.1.1 擴(kuò)張器的物理性能
3.1.1.1 外觀
用正常視力或矯正視力在放大 2.5 倍條件下檢查時(shí),應(yīng)符合 2.1.1.1 的要求��。
3.1.1.2 尺寸
以通用量具或?qū)S昧烤邫z測(cè)��,應(yīng)符合 2.1.1.2 的要求���。
3.1.1.3 座
按照 GB/T1962.1-2015 和/或 GB/T1962.2-2001 規(guī)定的方法進(jìn)行���,應(yīng)符合 2.1.1.3 的要
求�����。
更多檢驗(yàn)方法內(nèi)容����,請(qǐng)咨詢杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司。
二�����、導(dǎo)管鞘組工作原理
用于輔助輸送診斷/治療器械如導(dǎo)絲、導(dǎo)管等醫(yī)
療器械插入血管���,或建立有助于血管內(nèi)器械的經(jīng)皮進(jìn)入通路���。
對(duì)于采用特殊結(jié)構(gòu)設(shè)計(jì)、宣稱具有特定功能或采用新材料制
造的導(dǎo)管鞘組���,注冊(cè)申請(qǐng)人應(yīng)詳細(xì)說(shuō)明其工作原理和作用�。
結(jié)構(gòu)組成:明確產(chǎn)品的結(jié)構(gòu)組成(包括附件)����,并提供相應(yīng)
的結(jié)構(gòu)圖示。在圖示中標(biāo)識(shí)各部件的名稱�、尺寸信息及測(cè)量位置。
如管身采用多層結(jié)構(gòu)設(shè)計(jì)�,橫截面圖上宜體現(xiàn)多層結(jié)構(gòu);如管身
不同節(jié)段材料不同或編織方式不同��,軸向剖面圖上宜體現(xiàn)不同節(jié)
段����。對(duì)于表面有涂層的導(dǎo)管鞘,宜明確涂層的涂覆范圍(包括涂
層長(zhǎng)度)并描述涂層的涂覆方式�。如果導(dǎo)管鞘具有顯影環(huán)�����,宜明
確顯影環(huán)的位置����。
原材料:明確產(chǎn)品所有部件(包括附件)組成材料的通用名
稱/化學(xué)名稱����、商品名/牌號(hào)(若有)、符合的材料標(biāo)準(zhǔn)(如適用)
等基本信息���,包括導(dǎo)管鞘表面的涂層及制造過程中使用的焊接
劑�、粘合劑���、著色劑等。建議產(chǎn)品組成材料以列表的形式提供�����,
并與產(chǎn)品結(jié)構(gòu)圖示中標(biāo)識(shí)的部件一一對(duì)應(yīng)���。若產(chǎn)品組成材料為混
合物���,明確各組分及其比例���。對(duì)于采用分層/分段結(jié)構(gòu)設(shè)計(jì)的,
逐層/逐段分別進(jìn)行描述��。若為首次應(yīng)用于人體的新材料�����,應(yīng)明
確標(biāo)注�����。材料信息應(yīng)與注冊(cè)申報(bào)文件中描述一致����。
三、導(dǎo)管鞘組生物學(xué)特性研究
生物學(xué)特性研究
對(duì)于與患者直接或間接接觸的器械�����,應(yīng)當(dāng)進(jìn)行生物學(xué)評(píng)價(jià)��。
生物相容性評(píng)價(jià)研究資料應(yīng)當(dāng)包括:
①生物相容性評(píng)價(jià)的依據(jù)和方法
生物學(xué)評(píng)價(jià)依據(jù) GB/T16886.1《醫(yī)療器械生物學(xué)評(píng)價(jià) 第 1 部
分:風(fēng)險(xiǎn)管理過程中的評(píng)價(jià)與試驗(yàn)》及《醫(yī)療器械生物學(xué)評(píng)價(jià)和
審查指南》的相關(guān)要求開展���。
②產(chǎn)品所用材料的描述及與人體接觸的性質(zhì)
明確導(dǎo)管鞘組各組件的材質(zhì)��、產(chǎn)品與人體接觸的性質(zhì)以及接
觸時(shí)間�����。導(dǎo)管鞘��、擴(kuò)張器為與循環(huán)血液直接接觸的外部接入醫(yī)療
器械����,與人體的預(yù)期接觸時(shí)間小于 24 小時(shí),屬于短期接觸的類
型�。
③實(shí)施或豁免生物學(xué)試驗(yàn)的理由和論證
應(yīng)按照 GB/T16886 系列標(biāo)準(zhǔn)進(jìn)行生物學(xué)試驗(yàn)。使用其他同材
質(zhì)產(chǎn)品生物學(xué)試驗(yàn)報(bào)告豁免申報(bào)產(chǎn)品生物學(xué)試驗(yàn)時(shí)應(yīng)考慮上述
產(chǎn)品結(jié)構(gòu)����、預(yù)期與人體接觸性質(zhì)、設(shè)計(jì)和生產(chǎn)過程中可能引入的
污染物和殘留物�����、析出物(包括濾瀝物和/或蒸發(fā)物)���、降解產(chǎn)
物����、加工殘留物�、與醫(yī)療器械直接接觸的包裝材料等相關(guān)信息的
異同及對(duì)生物相容性的影響。
④對(duì)于現(xiàn)有數(shù)據(jù)或試驗(yàn)結(jié)果的評(píng)價(jià)�。
如需開展生物學(xué)試驗(yàn)的,試驗(yàn)項(xiàng)目建議至少考慮:細(xì)胞毒性��、
致敏反應(yīng)�����、皮內(nèi)反應(yīng)�����、材料介導(dǎo)的致熱性�、急性全身毒性、血液
相容性(溶血�、血栓)。
根據(jù)現(xiàn)有數(shù)據(jù)或試驗(yàn)結(jié)果�,生物學(xué)評(píng)價(jià)應(yīng)符合要求。
如有導(dǎo)管鞘組產(chǎn)品技術(shù)要求下載或是醫(yī)療器械注冊(cè)咨詢服務(wù)需求�,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò),聯(lián)系人:呂工,電話:18058734169���,微信同�����。