結(jié)腸息肉電子內(nèi)窺鏡圖像輔助檢測產(chǎn)品臨床試驗設(shè)計
一、結(jié)腸息肉電子內(nèi)窺鏡圖像輔助檢測產(chǎn)品試驗設(shè)計基本類型
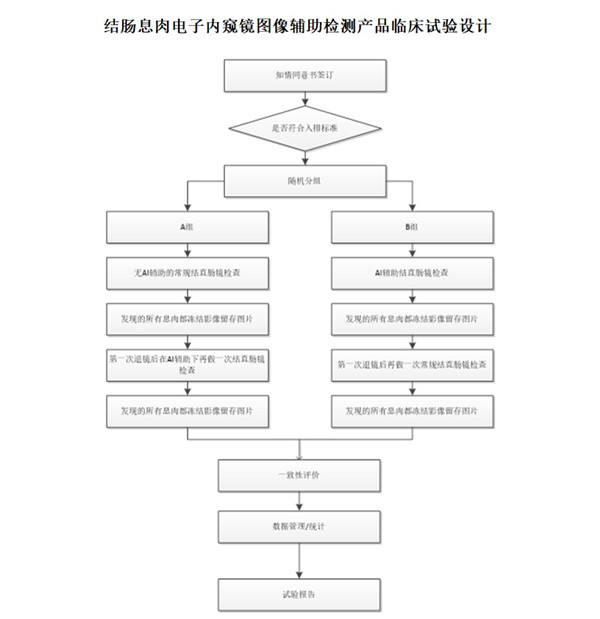
結(jié)腸息肉電子內(nèi)窺鏡圖像輔助檢測產(chǎn)品可考慮平行對照設(shè)計��,此處以序貫的平行對照為例進行說明��,申請人亦可采用其他科學(xué)的平行對照設(shè)計開展研究�,序貫的平行對照具體設(shè)計及試驗程序如下:
入組的受試者隨機分配到A組和B組�����,A組:常規(guī)結(jié)直腸鏡檢查先進行組:先接受無 AI 輔助的常規(guī)結(jié)直腸鏡檢查��,對檢查過程中發(fā)現(xiàn)的所有息肉都凍結(jié)影像留存圖片�。第一次退鏡后在AI 輔助下再做一次結(jié)直腸鏡檢查,對檢查過程中發(fā)現(xiàn)的所有息肉都凍結(jié)影像留存圖片�����。B 組:AI 輔助檢查先進行組:先接受 AI 輔助的結(jié)直腸鏡檢查�����,對檢查過程中發(fā)現(xiàn)的所有息肉都凍結(jié)影像留存圖片�����。第一次退鏡后再進行一次常規(guī)結(jié)直腸鏡檢查��,對檢查過程中發(fā)現(xiàn)的所有息肉都凍結(jié)影像留存圖片�����。分別以各組兩次檢出的腸息肉作為基準����,比較第一次檢查時,有AI輔助檢測和無AI輔助檢測的病變檢出能力��。原則上�����,結(jié)腸息肉人工智能輔助檢測產(chǎn)品臨床試驗需將前瞻性腸鏡檢查樣本作為臨床試驗研究對象�����。
二�����、評價指標
此類產(chǎn)品臨床試驗因不完美臨床參考標準等問題,可考慮選取息肉/腺瘤的初檢檢出率/漏診率或息肉檢出的靈敏度與特異性等作為主要評價指標����。相關(guān)指標需以息肉/腺瘤水平而非受試者水平進行計算,例如初檢息肉檢出率=初檢發(fā)現(xiàn)的息肉數(shù)量÷兩次檢測到的息肉總數(shù)��,腺瘤漏診率=第二次檢測到的腺瘤數(shù)÷兩次檢測到的腺瘤總數(shù)�。
次要評價指標可考慮息肉/腺瘤檢出率(受試者水平),平均息肉/腺瘤檢出數(shù)�,軟件獨立評估性能(即軟件獨立的息肉/腺瘤檢出率、息肉檢測準確性等):結(jié)直腸鏡操作時間(包括各次進鏡時間�����、退鏡時間)����、軟件易用性評價、穩(wěn)定性評價���、不良事件情況等�����。若同時觀察圖像傳輸�、儲存等非輔助決策臨床功能的性能表現(xiàn)����,亦可設(shè)立相應(yīng)次要評價指標。
三�、樣本量估算
1.以序貫的平行對照試驗為例,若采用腺瘤漏診率作為評價指標���,樣本量的計算基于腺瘤漏檢率的主要結(jié)果(每個病灶)���,假設(shè)如下: AI 先進行組別的腺瘤漏診率為 10%,標準檢查先進行組別的腺瘤漏診率為 30%����,優(yōu)效界值設(shè)定為0,在 80%統(tǒng)計功效的條件下�����, 雙側(cè)α值設(shè)為 0.05���。主要評價指標為初檢息肉檢出率:
假設(shè)每位患者的平均腺瘤數(shù)為 0.6����,考慮10%的脫落率,需入組220名受試者����,AI 先進行組110名,標準檢查先進行組110名�。
2.若采用初檢息肉檢出率作為主要評價指標,A 組: 常規(guī)結(jié)直腸鏡檢查先進行組���; B 組: AI 輔助檢查先進行組���。PC、 PT 分別為 A 組和 B 組預(yù)期初檢息肉檢出率�����,其中 PC=70%����、 PT=80%;|D|為兩組預(yù)期率差的絕對值�, |D| = |PC - PT|; Δ 為優(yōu)效性界值�,取 0����。主要評價指標為初檢息肉檢出率:
假設(shè)每位患者的平均息肉數(shù)為 2.5�����, 需約 234 例���,脫落率為 20%,最終樣本量為 296 例�����, A組和 B 組各 148 例��。
如有醫(yī)療器械臨床試驗設(shè)計服務(wù)需求����,歡迎您隨時方便與杭州證標客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò),聯(lián)系人:葉工����,電話:18058734169,微信同�����。